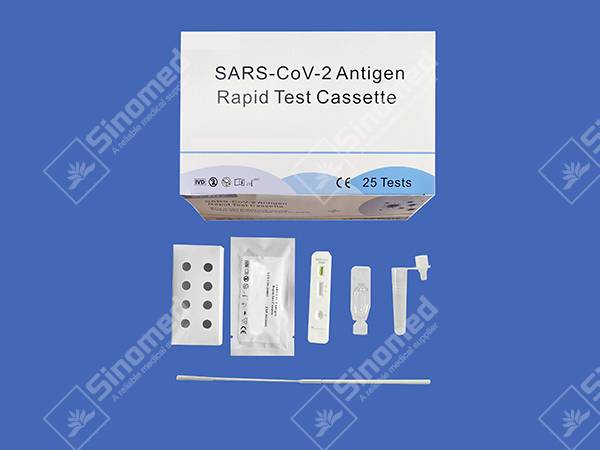
Casete de prueba rápida de antígeno del SARS-CoV-2
Descripción breve:
El casete de prueba rápida de antígeno del SARS-CoV-2 es un inmunoensayo cromatográfico rápido para la detección cualitativa del antígeno del SARS-CoV-2 en hisopos orofaríngeos humanos. La identificación se basa en los anticuerpos monoclonales específicos para la proteína nucleocápside (N) del SARS-CoV-2. Está destinado a ayudar en el diagnóstico diferencial rápido de la infección por COVID-19.
USO PREVISTO
ElCasete de prueba rápida de antígeno del SARS-CoV-2es un inmunoensayo cromatográfico rápido para la detección cualitativa del antígeno del SARS-CoV-2 en hisopos orofaríngeos humanos. La identificación se basa en los anticuerpos monoclonales específicos para la proteína nucleocápside (N) del SARS-CoV-2. Está destinado a ayudar en el diagnóstico diferencial rápido deCOVID-19infección.
Especificaciones del paquete
25 pruebas/paquete, 50 pruebas/paquete, 100 pruebas/paquete
INTRODUCCIÓN
Los nuevos coronavirus pertenecen al género β.COVID-19Es una enfermedad infecciosa respiratoria aguda. Las personas generalmente son susceptibles. Actualmente, los pacientes infectados por el nuevo coronavirus son la principal fuente de infección; las personas asintomáticas también pueden serlo. Según la investigación epidemiológica actual, el período de incubación es de 1 a 14 días, generalmente de 3 a 7 días. Las principales manifestaciones incluyen fiebre, fatiga y tos seca. En algunos casos, se presentan congestión nasal, rinorrea, dolor de garganta, mialgia y diarrea.
REACTIVOS
El casete de prueba contiene partículas de proteína nucleocápside anti-SARS-CoV-2 y proteína nucleocápside anti-SARS-CoV-2 recubierta en la membrana.
PRECAUCIONES
Lea toda la información contenida en este prospecto antes de realizar la prueba.
1. Solo para uso profesional de diagnóstico in vitro. No utilizar después de la fecha de caducidad.
2. La prueba debe permanecer en la bolsa sellada hasta que esté lista para usar.
3. Todas las muestras deben considerarse potencialmente peligrosas y manipularse de la misma manera que un agente infeccioso.
4.La prueba usada debe desecharse de acuerdo con las regulaciones locales.
5.Evite utilizar muestras con sangre.
6. Use guantes al manipular las muestras, evite tocar la membrana del reactivo y el pocillo de muestra.
ALMACENAMIENTO Y ESTABILIDAD
El período de validez es de 18 meses si este producto se almacena en un entorno de
2-30 ℃. La prueba es estable hasta la fecha de vencimiento impresa en la bolsa sellada. La prueba debe permanecer en la bolsa sellada hasta su uso..NO CONGELAR.No utilizar después de la fecha de caducidad.
RECOLECCIÓN Y PREPARACIÓN DE MUESTRAS
1. Recolección de secreciones de garganta: Inserte un hisopo estéril en la garganta completamente desde la boca, centrándose en la pared de la garganta y el área enrojecida de las amígdalas del paladar, limpie las amígdalas faríngeas bilaterales y la pared faríngea posterior con agua moderada.
Forzar, evitar tocar la lengua y retirar el hisopo.
2. Procese la muestra inmediatamente con la solución de extracción incluida en el kit tras su recolección. Si no se puede procesar inmediatamente, consérvela en un tubo de plástico seco, esterilizado y herméticamente cerrado. Puede conservarse a una temperatura de 2-8 °C durante 8 horas y a -70 °C durante un periodo prolongado.
3. Las muestras con alta contaminación por residuos de alimentos orales no pueden utilizarse para el análisis de este producto. No se recomienda el uso de muestras obtenidas con hisopos demasiado viscosos o aglomerados. Si los hisopos están contaminados con una gran cantidad de sangre, no se recomienda su uso. No se recomienda el uso de muestras procesadas con una solución de extracción de muestras no incluida en este kit para el análisis de este producto.
COMPONENTES DEL KIT
Los materiales proporcionan
| Casetes de prueba | Reactivo de extracción | Tubos de extracción | |
| Hisopos estériles | Prospecto del paquete | Estación de trabajo |
Materiales necesarios pero no proporcionados
| Minutero | Para uso cronometrador. |
| Paquete |
Especificaciones25
pruebas/paquete50
pruebas/paquete100
Pruebas/paquete Reactivo de extracción de muestras 25 pruebas/paquete 50 pruebas/paquete 100 pruebas/paquete Extracción de muestras
tubo≥25 pruebas/paquete≥50 pruebas/paquete≥100 pruebas/paqueteInstrucciónConsulte la
Paquete Consulte el
Paquete Consulte el
paquete
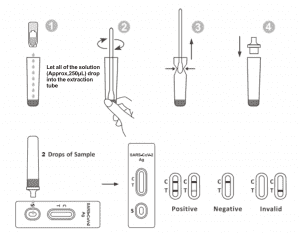
MODO DE EMPLEO
Deje que la prueba, la muestra y el tampón de extracción se equilibren a temperatura ambiente (15-30 ℃) antes de realizar la prueba.
1. Retire el casete de prueba de la bolsa sellada y úselo dentro de los 15 minutos. Se obtendrán mejores resultados si el ensayo se realiza inmediatamente después de abrir la bolsa.
2. Coloque el tubo de extracción en la estación de trabajo. Sostenga la botella de reactivo de extracción boca abajo en posición vertical. Apriete la botella y deje que toda la solución (aproximadamente 250 μL) caiga en el tubo de extracción libremente sin que el borde del tubo toque el tubo de extracción.
3. Coloque la muestra del hisopo en el tubo de extracción. Gire el hisopo durante aproximadamente 10 segundos mientras presiona la cabeza contra el interior del tubo para liberar el antígeno del hisopo.
4. Retire el hisopo mientras aprieta la cabeza del hisopo contra el interior del tubo de extracción mientras lo retira para expulsar la mayor cantidad de líquido posible del hisopo. Deseche el hisopo de acuerdo con su protocolo de eliminación de desechos biológicos.
5. Coloque la punta del gotero en la parte superior del tubo de extracción. Coloque el casete de prueba sobre una superficie limpia y nivelada.
6. Agregue 2 gotas de la solución (aproximadamente 65 μL) al pocillo de muestra y luego inicie el temporizador. Lea el resultado mostrado dentro de 20 a 30 minutos y los resultados leídos después de 30 minutos no son válidos.
INTERPRETACIÓN DE LOS RESULTADOS
| NEGATIVO RESULTADO: |
Aparece una línea de color en la región de la línea de control (C). No aparece ninguna línea en la región de prueba (T). Un resultado negativo indica que el antígeno del SARS-CoV-2 no está presente en la muestra o que su nivel es inferior al detectable en la prueba.
POSITIVORESULTADO:
Aparecen dos líneas. Una línea coloreada debe estar en la región de control (C) y otra línea coloreada aparente debe estar en la región de prueba (T). Un resultado positivo indica que se detectó SARS-CoV-2 en la muestra.
RESULTADO INVÁLIDO:
La línea de control no aparece. Un volumen de muestra insuficiente o técnicas de procedimiento incorrectas son las causas más probables del fallo de la línea de control. Revise el procedimiento y repita la prueba con una nueva. Si el problema persiste, suspenda el uso del kit de prueba inmediatamente y contacte a su distribuidor local.
NOTA:
La intensidad del color en la región de la línea de prueba (T) variará según la concentración de antígeno del SARS-CoV-2 presente en la muestra. Por lo tanto, cualquier tono de color en la región de la línea de prueba (T) debe considerarse positivo.
CONTROL DE CALIDAD
- La prueba incluye un control de procedimiento. La línea de color que aparece en la región de control (C) se considera un control de procedimiento interno. Confirma una absorción adecuada de la membrana.
- Este kit no incluye estándares de control; sin embargo, se recomienda probar controles positivos y negativos como una buena práctica de laboratorio para confirmar el procedimiento de prueba y verificar el desempeño adecuado de la misma.
LIMITACIONESDE LA PRUEBA
- El casete de prueba rápida de antígeno del SARS-CoV-2 es solo para uso diagnóstico in vitro profesional. La prueba debe utilizarse para la detección del antígeno del SARS-CoV-2 en un hisopo orofaríngeo. Ni el valor cuantitativo ni la tasa de aumento de la concentración del SARS-CoV-2 se pueden determinar mediante esta prueba cualitativa.
- La precisión de la prueba depende de la calidad de la muestra del hisopo. Pueden producirse falsos negativos si la recolección de muestras no se almacena adecuadamente.
- El casete de prueba rápida de antígeno del SARS-CoV-2 solo indicará la presencia de SARS-CoV-2 en la muestra de cepas de coronavirus SARS-CoV-2 viables y no viables.
- Como ocurre con todas las pruebas diagnósticas, todos los resultados deben interpretarse junto con otra información clínica disponible para el médico.
- Un resultado negativo obtenido con este kit debe confirmarse mediante PCR. Se puede obtener un resultado negativo si la concentración de SARS-CoV-2 presente en el hisopo no es adecuada o está por debajo del nivel detectable de la prueba.
- El exceso de sangre o moco en la muestra del hisopo puede interferir con el rendimiento y producir un resultado falso positivo.
- Un resultado positivo para SARS-CoV-2 no descarta una coinfección subyacente con otro patógeno. Por lo tanto, debe considerarse la posibilidad de una infección bacteriana subyacente.
- Los resultados negativos no descartan la infección por SARS-CoV-2, especialmente en quienes han estado en contacto con el virus. Se debe considerar la realización de pruebas de seguimiento con un diagnóstico molecular para descartar la infección en estas personas.
- Los resultados positivos pueden deberse a una infección actual con cepas de coronavirus distintas del SARS-CoV-2, como el coronavirus HKU1, NL63, OC43 o 229E.
- Los resultados de las pruebas de antígenos no deben utilizarse como única base para diagnosticar o excluir la infección por SARS-CoV-2 o para informar el estado de la infección.
- El reactivo de extracción tiene la capacidad de matar el virus, pero no puede inactivar el 100% del virus. El método de inactivación del virus puede consultarse en: qué método recomienda la OMS/CDC, o puede manejarse de acuerdo con las regulaciones locales.
CARACTERÍSTICAS DE RENDIMIENTO
SensibilidadyEspecificidad
El casete de prueba rápida de antígeno del SARS-CoV-2 se ha evaluado con muestras obtenidas de los pacientes. La PCR se utiliza como método de referencia para el casete de prueba rápida de antígeno del SARS-CoV-2. Las muestras se consideraron positivas si la PCR indicó un resultado positivo.
| Método | RT-PCR | Resultados totales | ||
| Casete de prueba rápida de antígeno del SARS-CoV-2 | Resultados | Positivo | Negativo | |
| Positivo | 38 | 3 | 41 | |
| Negativo | 2 | 360 | 362 | |
| Resultados totales | 40 | 363 | 403 | |
Sensibilidad relativa: 95,0 % (IC del 95 %*: 83,1 %-99,4 %)
Especificidad relativa: 99,2 % (IC del 95 %*: 97,6 %-99,8 %)
*Intervalos de confianza
Límite de detección
Cuando el contenido de virus es superior a 400 TCID50/ml, la tasa de detección positiva es superior al 95 %. Cuando el contenido de virus es inferior a 200 TCID50/ml, la tasa de detección positiva es inferior al 95%, por lo que el límite mínimo de detección de este producto es 400 TCID50/ml.
Precisión
Se analizaron tres lotes consecutivos de reactivos para comprobar su precisión. Se utilizaron diferentes lotes para analizar la misma muestra negativa diez veces consecutivas, y todos los resultados fueron negativos. Se utilizaron diferentes lotes para analizar la misma muestra positiva diez veces consecutivas, y todos los resultados fueron positivos.
Efecto GANCHO
Cuando el contenido de virus en la muestra a analizar alcance 4,0*105TCID50/ml, el resultado de la prueba aún no muestra el efecto HOOK.
Reactividad cruzada
Se evaluó la reactividad cruzada del kit. Los resultados no mostraron reactividad cruzada con la siguiente muestra.
| Nombre | Concentración |
| HCOV-HKU1 | 105TCID50/ml |
| Estafilococo áureo | 106TCID50/ml |
| estreptococos del grupo A | 106TCID50/ml |
| Virus del sarampión | 105TCID50/ml |
| Virus de las paperas | 105TCID50/ml |
| Adenovirus tipo 3 | 105TCID50/ml |
| neumonía por micoplasma | 106TCID50/ml |
| Virus parainfluenza tipo 2 | 105TCID50/ml |
| metapneumovirus humano | 105TCID50/ml |
| Coronavirus humano OC43 | 105TCID50/ml |
| Coronavirus humano 229E | 105TCID50/ml |
| Bordetella parapertusis | 106TCID50/ml |
| Influenza B Victoria CEPA | 105TCID50/ml |
| Influenza B CEPA | 105TCID50/ml |
| Gripe A H1N1 2009 | 105TCID50/ml |
| Gripe A H3N2 | 105TCID50/ml |
| H7N9 | 105TCID50/ml |
| H5N1 | 105TCID50/ml |
| Virus de Epstein-Barr | 105TCID50/ml |
| Enterovirus CA16 | 105TCID50/ml |
| Rinovirus | 105TCID50/ml |
| Virus sincitial respiratorio | 105TCID50/ml |
| Streptococcus pneumoni-ae | 106TCID50/ml |
| Candida albicans | 106TCID50/ml |
| Chlamydia pneumoniae | 106TCID50/ml |
| Bordetella pertussis | 106TCID50/ml |
| Pneumocystis jiroveci | 106TCID50/ml |
| Mycobacterium tuberculosis | 106TCID50/ml |
| Legionella pneumophila | 106TCID50/ml |
ISustancias que interfieren
Los resultados de la prueba no se verán alterados por la sustancia en la siguiente concentración:
| Entrometido sustancia | Concentración. | Sustancia interferente | Concentración. |
| Sangre entera | 4% | Gel de benjuí compuesto | 1,5 mg/ml |
| Ibuprofeno | 1 mg/ml | Glicato de cromoglicato | 15% |
| tetraciclina | 3 ug/ml | cloranfenicol | 3 ug/ml |
| Mucina | 0,5% | Mupirocina | 10 mg/ml |
| Eritromicina | 3 ug/ml | Oseltamivir | 5 mg/ml |
| Tobramicina | 5% | Gotas nasales de hidrocloruro de nafazolina | 15% |
| mentol | 15% | aerosol de propionato de fluticasona | 15% |
| Afrín | 15% | Clorhidrato de desoxiepinefrina | 15% |
BIBLIOGRAFÍA
1. Weiss SR, Leibowitz JZ. Patogénesis del coronavirus. Adv Virus Res 2011;81:85-164
2.Cui J,Li F,Shi ZL.Origen y evolución de los coronavirus patógenos.Nat Rev Microbiol 2019;17:181-192.
3. Su S, Wong G, Shi W, et al. Epidemiología, recombinación genética y patogénesis de los coronavirus. Trends Microbiol 2016;24:490-502.