Casete de prueba rápida del antígeno SARS-CoV-2
Breve descripción:
El casete de prueba rápida del antígeno del SARS-CoV-2 es un inmunoensayo cromatográfico rápido para la detección cualitativa del antígeno del SARS-CoV-2 en hisopos orofaríngeos humanos. La identificación se basa en los anticuerpos monoclonales específicos de la proteína nucleocápside (N) del SARS- CoV-2. Está destinado a ayudar en el diagnóstico diferencial rápido de la infección por COVID-19.
USO PREVISTO
ElCasete de prueba rápida del antígeno SARS-CoV-2es un inmunoensayo cromatográfico rápido para la detección cualitativa del antígeno del SARS-CoV-2 en hisopos orofaríngeos humanos. La identificación se basa en los anticuerpos monoclonales específicos de la proteína nucleocápside (N) del SARS-CoV-2. Está destinado a ayudar en el diagnóstico diferencial rápido deCOVID-19infección.
Especificaciones del paquete
25 pruebas/paquete, 50 pruebas/paquete, 100 pruebas/paquete
INTRODUCCIÓN
Los nuevos coronavirus pertenecen al género β.COVID-19es una enfermedad infecciosa respiratoria aguda. Las personas generalmente son susceptibles. Actualmente, los pacientes infectados por el nuevo coronavirus son la principal fuente de infección; las personas infectadas asintomáticas también pueden ser una fuente infecciosa. Según la investigación epidemiológica actual, el período de incubación es 1 a 14 días, principalmente de 3 a 7 días.Las principales manifestaciones incluyen fiebre, fatiga y tos seca.En algunos casos se encuentran congestión nasal, secreción nasal, dolor de garganta, mialgia y diarrea.
REACTIVOS
El casete de prueba contiene partículas de proteína de nucleocápside anti-SARS-CoV-2 y proteína de nucleocápside anti-SARS-CoV-2 recubierta en la membrana.
PRECAUCIONES
Lea toda la información en este prospecto antes de realizar la prueba.
1.Solo para uso profesional de diagnóstico in vitro.No utilizar después de la fecha de vencimiento.
2.La prueba debe permanecer en la bolsa sellada hasta que esté lista para usarse.
3. Todas las muestras deben considerarse potencialmente peligrosas y manipularse de la misma manera que un agente infeccioso.
4. La prueba utilizada debe desecharse según las normas locales.
5.Evite el uso de muestras con sangre.
6.Use guantes al entregar las muestras, evite tocar la membrana del reactivo y la muestra.
ALMACENAMIENTO Y ESTABILIDAD
El período de validez es de 18 meses si este producto se almacena en un ambiente de
2-30 ℃. La prueba es estable hasta la fecha de vencimiento impresa en la bolsa sellada. La prueba debe permanecer en la bolsa sellada hasta su uso..NO CONGELAR.No lo use más allá de la fecha de vencimiento.
TOMA Y PREPARACIÓN DE MUESTRAS
1.Recolección de secreciones de la garganta: inserte un hisopo estéril en la garganta completamente desde la boca, centrándose en la pared de la garganta y el área enrojecida de las amígdalas del paladar, limpie las amígdalas faríngeas bilaterales y la pared faríngea posterior con gas moderado.
fuerza, evite tocar la lengua y saque el hisopo.
2. Procese la muestra inmediatamente con la solución de extracción de muestras proporcionada en el kit después de recolectar la muestra.Si no se puede procesar inmediatamente, la muestra debe almacenarse en un tubo de plástico seco, esterilizado y estrictamente sellado.Se puede almacenar a 2-8 ℃ durante 8 horas y se puede almacenar durante mucho tiempo a -70 ℃.
3. Las muestras que estén muy contaminadas con residuos de alimentos orales no se pueden utilizar para analizar este producto.No se recomiendan muestras recolectadas de hisopos que sean demasiado viscosos o aglomerados para analizar este producto.Si los hisopos están contaminados con una gran cantidad de sangre, no se recomienda realizar pruebas.No se recomienda utilizar muestras procesadas con una solución de extracción de muestras que no se proporciona en este kit para probar este producto.
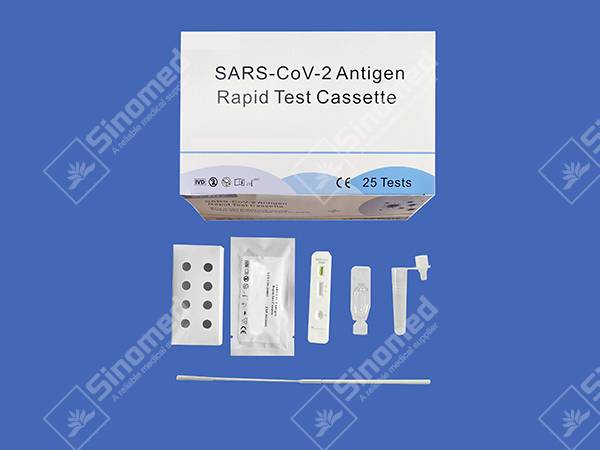
COMPONENTES DEL KIT
Los materiales proporcionan
| Casetes de prueba | Reactivo de extracción | Tubos de extracción | |
| Hisopos estériles | Insertar paquete | Estación de trabajo |
Materiales requeridos pero no proporcionados.
| Temporizador | Para uso en cronometraje. |
| Paquete |
Especificaciones25
pruebas/paquete50
pruebas/paquete100
pruebas/paqueteReactivo de extracción de muestras25 pruebas/paquete50 pruebas/paquete100 pruebas/paqueteExtracción de muestras
tubo≥25 pruebas/paquete≥50 pruebas/paquete≥100 pruebas/paqueteInstrucciónConsulte la
paqueteConsulte el
paqueteConsulte el
paquete
INSTRUCCIONES DE USO
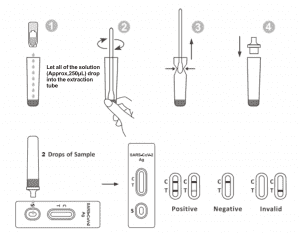
Deje que la prueba, la muestra y el tampón de extracción se equilibren a temperatura ambiente (15-30 ℃) antes de realizar la prueba.
1.Retire el casete de prueba de la bolsa de aluminio sellada y utilícelo dentro de los 15 minutos.Se obtendrán mejores resultados si el ensayo se realiza inmediatamente después de abrir la bolsa de aluminio.
2.Coloque el tubo de extracción en la estación de trabajo. Sostenga la botella de reactivo de extracción boca abajo verticalmente. Apriete la botella y deje que toda la solución (aproximadamente 250 μl) caiga libremente en el tubo de extracción sin tocar el borde del tubo con la extracción. Tubo.
3.Coloque la muestra del hisopo en el tubo de extracción. Gire el hisopo durante aproximadamente 10 segundos mientras presiona el cabezal contra el interior del tubo para liberar el antígeno en el hisopo.
4.Retire el hisopo mientras aprieta el cabezal del hisopo contra el interior del tubo de extracción mientras lo retira para expulsar la mayor cantidad de líquido posible del hisopo. Deseche el hisopo de acuerdo con su protocolo de eliminación de desechos con riesgo biológico.
5.Coloque la punta del gotero en la parte superior del tubo de extracción.Coloque el casete de prueba sobre una superficie limpia y nivelada.
6.Agregue 2 gotas de la solución (aproximadamente 65 μl) al pocillo de muestra y luego inicie el cronómetro. Lea el resultado mostrado dentro de 20 a 30 minutos y los resultados leídos después de 30 minutos no son válidos.
INTERPRETACIÓN DE RESULTADOS
| NEGATIVO RESULTADO: |
Aparece una línea de color en la región de la línea de control (C).No aparece ninguna línea en la región de la prueba (T). Un resultado negativo indica que el antígeno del SARS-CoV-2 no está presente en la muestra o está presente por debajo del nivel detectable de la prueba.
POSITIVORESULTADO:
Aparecen dos líneas. Una línea de color debe estar en la región de control (C) y otra línea de color aparente debe estar en la región de prueba (T). Un resultado positivo indica que se detectó SARS-CoV-2 en la muestra.
RESULTADO NO VÁLIDO:
La línea de control no aparece. Un volumen de muestra insuficiente o técnicas de procedimiento incorrectas son las razones más probables del fallo de la línea de control.Revise el procedimiento y repita la prueba con una nueva prueba.Si el problema persiste, deje de usar el kit de prueba inmediatamente y comuníquese con su distribuidor local.
NOTA:
La intensidad del color en la región de la línea de prueba (T) variará según la concentración del antígeno del SARS-CoV-2 presente en la muestra.Por lo tanto, cualquier tono de color en la región de la línea de prueba (T) debe considerarse positivo.
CONTROL DE CALIDAD
- En la prueba se incluye un control de procedimiento.Una línea de color que aparece en la región de control (C) se considera un control de procedimiento interno y confirma una absorción adecuada de la membrana.
- Los estándares de control no se suministran con este kit;sin embargo, se recomienda probar controles positivos y negativos como buena práctica de laboratorio para confirmar el procedimiento de prueba y verificar el desempeño adecuado de la prueba.
LIMITACIONESDEL EXAMEN
- ElCasete de prueba rápida del antígeno SARS-CoV-2es solo para uso profesional de diagnóstico in vitro. La prueba debe usarse para la detección del antígeno del SARS-CoV-2 en un hisopo orofaríngeo. Ni el valor cuantitativo ni la tasa de aumento en la concentración del SARS-CoV-2 pueden determinarse mediante esta prueba cualitativa. prueba.
- La precisión de la prueba depende de la calidad de la muestra del hisopo. Pueden producirse falsos negativos debido al almacenamiento inadecuado de la muestra.
- El casete de prueba rápida de antígeno del SARS-CoV-2 solo indicará la presencia de SARS-CoV-2 en la muestra de cepas de coronavirus del SARS-CoV-2 viables y no viables.
- Como ocurre con todas las pruebas de diagnóstico, todos los resultados deben interpretarse junto con otra información clínica disponible para el médico.
- Un resultado negativo obtenido con este kit debe confirmarse mediante PCR. Se puede obtener un resultado negativo si la concentración del SARS-CoV-2 presente en el hisopo no es adecuada o está por debajo del nivel detectable de la prueba.
- El exceso de sangre o moco en la muestra del hisopo puede interferir con el rendimiento y producir un resultado falso positivo.
- Un resultado positivo para SARS-CoV-2 no excluye una coinfección subyacente con otro patógeno.Por lo tanto, se debe considerar la posibilidad de una infección bacteriana subyacente.
- Los resultados negativos no descartan la infección por SARS-CoV-2, especialmente en quienes han estado en contacto con el virus.Se deben considerar pruebas de seguimiento con un diagnóstico molecular para descartar infección en estos individuos.
- Los resultados positivos pueden deberse a una infección actual con cepas de coronavirus distintas del SARS-CoV-2, como el coronavirus HKU1, NL63, OC43 o 229E.
- Los resultados de las pruebas de antígenos no deben utilizarse como única base para diagnosticar o excluir la infección por SARS-CoV-2 o para informar el estado de la infección.
- El reactivo de extracción tiene la capacidad de matar el virus, pero no puede inactivarlo al 100%. El método de inactivación del virus puede consultarse: qué método recomienda la OMS/CDC, o puede manipularse de acuerdo con las regulaciones locales.
CARACTERÍSTICAS DE PRESENTACIÓN
SensibilidadyEspecificidad
El casete de prueba rápida de antígeno del SARS-CoV-2 se ha evaluado con muestras obtenidas de los pacientes. La PCR se utiliza como método de referencia para el casete de prueba rápida de antígeno del SARS-CoV-2. Las muestras se consideraron positivas si la PCR indicaba un resultado positivo.
| Método | RT-PCR | Resultados totales | ||
| Casete de prueba rápida del antígeno SARS-CoV-2 | Resultados | Positivo | Negativo | |
| Positivo | 38 | 3 | 41 | |
| Negativo | 2 | 360 | 362 | |
| Resultados totales | 40 | 363 | 403 | |
Sensibilidad relativa: 95,0 % (IC 95 %*: 83,1 %-99,4 %)
Especificidad relativa: 99,2 % (IC del 95 %*: 97,6 %-99,8 %)
*Intervalos de confianza
Límite de detección
Cuando el contenido del virus es superior a 400 TCID50/ml, la tasa de detección positiva es superior al 95%.Cuando el contenido del virus es inferior a 200 TCID50/ml, la tasa de detección positiva es inferior al 95%, por lo que el límite mínimo de detección de este producto es 400TCID50/ml.
Precisión
Se probó la precisión de tres lotes consecutivos de reactivos.Se utilizaron diferentes lotes de reactivos para analizar la misma muestra negativa 10 veces seguidas y todos los resultados fueron negativos.Se utilizaron diferentes lotes de reactivos para analizar la misma muestra positiva 10 veces seguidas y todos los resultados fueron positivos.
Efecto GANCHO
Cuando el contenido de virus en la muestra a analizar alcanza 4,0*105TCID50/ml, el resultado de la prueba aún no muestra el efecto HOOK.
Reactividad cruzada
Se evaluó la reactividad cruzada del kit.Los resultados no mostraron reactividad cruzada con la siguiente muestra.
| Nombre | Concentración |
| VHC-HKU1 | 105TCID50/ml |
| Estafilococo aureus | 106TCID50/ml |
| Estreptococos del grupo A | 106TCID50/ml |
| Virus del sarampión | 105TCID50/ml |
| Virus de las paperas | 105TCID50/ml |
| Adenovirus tipo 3 | 105TCID50/ml |
| Neumonía por micoplasma | 106TCID50/ml |
| Paraimfluenzavirus, tipo 2 | 105TCID50/ml |
| metaneumovirus humano | 105TCID50/ml |
| Coronavirus humano OC43 | 105TCID50/ml |
| coronavirus humano 229E | 105TCID50/ml |
| Bordetella parapertusis | 106TCID50/ml |
| Gripe B Victoria CEPA | 105TCID50/ml |
| Gripe por cepa | 105TCID50/ml |
| Gripe A H1N1 2009 | 105TCID50/ml |
| Gripe A H3N2 | 105TCID50/ml |
| H7N9 | 105TCID50/ml |
| H5N1 | 105TCID50/ml |
| Virus de Epstein Barr | 105TCID50/ml |
| Enterovirus CA16 | 105TCID50/ml |
| Rinovirus | 105TCID50/ml |
| Virus sincitial respiratorio | 105TCID50/ml |
| Steotococos neumonia | 106TCID50/ml |
| Candida albicans | 106TCID50/ml |
| clamidia neumonía | 106TCID50/ml |
| Bordetella pertussis | 106TCID50/ml |
| Pneumocystis jiroveci | 106TCID50/ml |
| Tuberculosis micobacteriana | 106TCID50/ml |
| Legionella pneumophila | 106TCID50/ml |
ISustancias que interfieren
Los resultados de la prueba no se verán afectados por la sustancia en la siguiente concentración:
| Entrometido sustancia | Conc. | Sustancia que interfiere | Conc. |
| Sangre pura | 4% | Gel compuesto de benjuí | 1,5 mg/ml |
| Ibuprofeno | 1mg/ml | glicato de cromolín | 15% |
| tetraciclina | 3ug/ml | cloranfenicol | 3ug/ml |
| mucina | 0,5% | mupirocina | 10mg/ml |
| Eritromicina | 3ug/ml | oseltamivir | 5mg/ml |
| tobramicina | 5% | Gotas nasales de clorhidrato de nafazolina | 15% |
| mentol | 15% | Aerosol de propionato de fluticasona | 15% |
| Afrin | 15% | Clorhidrato de desoxiepinefrina | 15% |
IBIBLIOGRAFÍA
1.Weiss SR, Leibowitz JZ.Patogénesis del coronavirus.Adv Virus Res 2011;81:85-164
2.Cui J,Li F,Shi ZL.Origen y evolución de los coronavirus patógenos.Nat Rev Microbiol 2019;17:181-192.
3.Su S, Wong G, Shi W, et al. Epidemiología, recombinación genética y patogénesis de los coronavirus.TendenciasMicrobiol 2016;24:490-502.