SARS-CoV-2抗原迅速検査カセット
簡単な説明:
SARS-CoV-2抗原迅速検査カセットは、ヒト口腔咽頭スワブ中のSARS-CoV-2抗原を定性的に検出するための迅速なクロマトグラフィー免疫測定法です。SARS-CoV-2のヌクレオカプシド(N)タンパク質に特異的なモノクローナル抗体に基づいて識別されます。COVID-19感染の迅速な鑑別診断を支援することを目的としています。
使用目的
そのSARS-CoV-2抗原迅速検査カセットは、ヒト口腔咽頭スワブ中のSARS-CoV-2抗原を定性的に検出するための迅速なクロマトグラフィー免疫測定法です。同定は、SARS-CoV-2のヌクレオカプシド(N)タンパク質に特異的なモノクローナル抗体に基づいています。これは、SARS-CoV-2の迅速な鑑別診断を支援することを目的としています。COVID-19(新型コロナウイルス感染症感染。
パッケージ仕様
25 テスト/パック、50 テスト/パック、100 テスト/パック
導入
新型コロナウイルスはβ属に属します。COVID-19(新型コロナウイルス感染症急性呼吸器感染症です。一般的に感染力があります。現在、新型コロナウイルスに感染した患者が主な感染源となっていますが、無症状の感染者も感染源となる可能性があります。最新の疫学調査によると、潜伏期間は1~14日で、多くは3~7日です。主な症状は発熱、倦怠感、空咳です。鼻づまり、鼻水、咽頭痛、筋肉痛、下痢などの症状が現れる場合もあります。
試薬
検査カセットには、抗SARS-CoV-2ヌクレオカプシドタンパク質粒子と、膜にコーティングされた抗SARS-CoV-2ヌクレオカプシドタンパク質が含まれています。
予防
テストを実行する前に、この添付文書のすべての情報をお読みください。
1. 専門家による体外診断用としてのみご使用ください。使用期限を過ぎた製品は使用しないでください。
2. テストは、使用する準備ができるまで密封された袋に入れたままにしておきます。
3. すべての検体は潜在的に危険であるとみなされ、感染源と同じ方法で取り扱われるべきです。
4.使用済みのテストは、現地の規制に従って廃棄する必要があります。
5.血液サンプルの使用は避けてください。
6.サンプルを扱うときは手袋を着用し、試薬膜やサンプルに十分触れないようにしてください。
保管と安定性
この製品を以下の環境で保管した場合、有効期間は18ヶ月です。
2〜30℃。テストは密封された袋に印刷された有効期限まで安定しています。テストは使用するまで密封された袋に入れたままにする必要があります。凍らせないでください。使用期限を過ぎた場合は使用しないでください。
標本の採取と準備
1.咽頭分泌物採取:滅菌綿棒を口から完全に咽頭に挿入し、咽頭壁と口蓋扁桃の赤くなった部分を中心に、両側の咽頭扁桃と後咽頭壁を中程度の圧力で拭う。
力を入れずに舌に触れないようにして綿棒を取り出します。
2. サンプル採取後、キットに同梱されているサンプル抽出液で直ちに処理してください。直ちに処理できない場合は、乾燥した滅菌済みの密閉容器に入れて保存してください。2~8℃で8時間保存でき、-70℃で長期保存も可能です。
3. 口腔内の食物残留物でひどく汚染された検体は、本製品の検査には使用できません。粘性が高すぎたり、凝集している綿棒から採取した検体も、本製品の検査には推奨されません。綿棒に大量の血液が汚染されている場合も、検査には推奨されません。本キットに含まれていない検体抽出液で処理した検体は、本製品の検査には推奨されません。
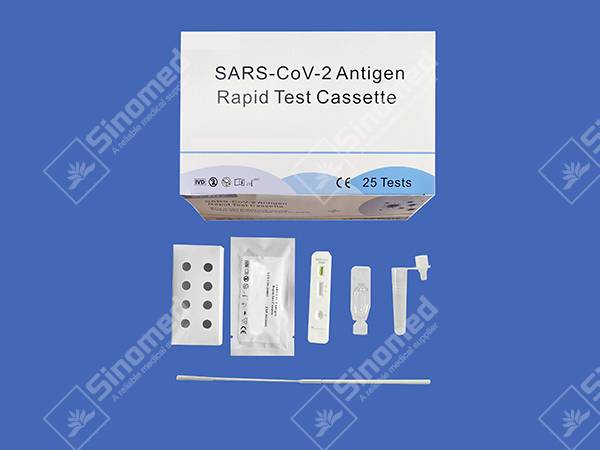
キット構成
材料は
| テストカセット | 抽出試薬 | 抽出チューブ | |
| 滅菌綿棒 | 添付文書 | ワークステーション |
必要な材料は提供されない
| タイマー | タイミング用です。 |
| パッケージ |
仕様25
テスト/パック50
テスト/パック100
テスト/パックサンプル抽出試薬25テスト/パック50テスト/パック100テスト/パックサンプル抽出
チューブ≥25テスト/パック≥50テスト/パック≥100テスト/パック説明書を参照してください
パッケージを参照してください
パッケージを参照してください
パッケージ
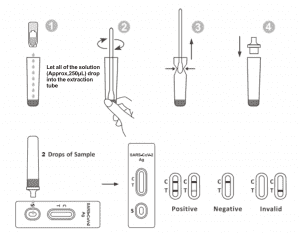
使用方法
試験前に、試験物、検体、抽出バッファーを室温(15〜30℃)に戻してください。
1. テストカセットを密封されたアルミ袋から取り出し、15分以内に使用してください。アルミ袋を開封後すぐに検査を行うと、最良の結果が得られます。
2.抽出チューブを作業ステーションに置きます。抽出試薬ボトルを逆さまにして垂直に持ちます。ボトルを握り、チューブの端が抽出チューブに触れないようにしながら、溶液のすべて(約250μL)を抽出チューブに自由に落とします。
3.綿棒検体を抽出チューブに入れます。チューブの内側に綿棒の先端を押し当てながら約10秒間回転させ、綿棒内の抗原を放出します。
4. 綿棒を抜くときは、綿棒のヘッドを抽出チューブの内側に押し当てて、綿棒からできるだけ多くの液体を排出します。綿棒は、バイオハザード廃棄物処理プロトコルに従って廃棄してください。
5. スポイトの先端を抽出チューブの上部に取り付けます。テストカセットを清潔で水平な面に置きます。
6.サンプルウェルに溶液を2滴(約65μL)加え、タイマーを開始します。表示された結果を20〜30分以内に読み取ります。30分後に読み取った結果は無効です。
結果の解釈
| ネガティブ 結果: |
コントロールライン領域(C)に1本の線が現れます。テスト領域(T)には線は現れません。陰性の結果は、検体中にSARS-CoV-2抗原が存在しない、または検査の検出限界以下であることを示します。
ポジティブ結果:
2 本の線が現れます。1 本の色のついた線はコントロール領域 (C) にあり、もう 1 本の色のついた線はテスト領域 (T) にあるはずです。陽性の結果は、検体で SARS-CoV-2 が検出されたことを示します。
無効な結果:
コントロールラインが出ません。コントロールラインが出ない原因として最も可能性が高いのは、検体量が不十分であるか、手順が不適切であることです。手順を見直し、新しい検査項目で検査を再度行ってください。問題が解決しない場合は、直ちに検査キットの使用を中止し、お近くの販売店にご連絡ください。
注記:
判定ライン領域(T)の色の濃淡は、検体中に存在するSARS-CoV-2抗原の濃度によって異なります。したがって、判定ライン領域(T)の色の濃淡は、陽性と判断する必要があります。
品質管理
- 試験には手順コントロールが含まれています。コントロール領域(C)に現れる色付きの線は、内部手順コントロールとみなされ、膜ウィッキングが適切であることを示します。
- このキットにはコントロール標準は付属していませんが、テスト手順を確認し、適切なテストパフォーマンスを検証するための優れた実験室慣行として、陽性コントロールと陰性コントロールをテストすることをお勧めします。
制限事項テストの
- SARS-CoV-2 抗原迅速検査カセットは、専門的な体外診断用途にのみ使用されます。この検査は、口腔咽頭スワブ中の SARS-CoV-2 抗原の検出に使用する必要があります。この定性検査では、SARS-CoV-2 濃度の定量値も増加率も判定できません。
- 検査の精度は綿棒サンプルの品質に依存します。サンプル収集の保管が不適切な場合、偽陰性が発生する可能性があります。
- SARS-CoV-2 抗原迅速検査カセットは、生存可能な SARS-CoV-2 コロナウイルス株と非生存可能な SARS-CoV-2 コロナウイルス株の両方から採取した検体中の SARS-CoV-2 の存在のみを示します。
- すべての診断テストと同様に、すべての結果は医師が入手できる他の臨床情報と併せて解釈する必要があります。
- このキットで得られた陰性の結果は、PCR によって確認する必要があります。綿棒内に存在する SARS-CoV-2 の濃度が適切でないか、検査の検出レベルを下回る場合、陰性の結果が得られる可能性があります。
- 綿棒検体に過剰な血液や粘液が付着していると、検査結果に支障をきたし、偽陽性の結果が出る可能性があります。
- SARS-CoV-2の陽性結果は、他の病原体との重複感染の可能性を排除するものではありません。したがって、早期の細菌感染の可能性を考慮する必要があります。
- 陰性の結果は、特にウイルスに接触したことがある人の場合、SARS-CoV-2感染を否定するものではありません。これらの人については、感染を除外するために分子診断による追跡検査を検討する必要があります。
- 陽性の結果は、コロナウイルス HKU1、NL63、OC43、または 229E などの SARS-CoV-2 以外のコロナウイルス株による現在の感染が原因である可能性があります。
- 抗原検査の結果は、SARS-CoV-2 感染を診断または除外するため、あるいは感染状態を知らせるための唯一の根拠として使用すべきではありません。
- 抽出試薬にはウイルスを殺す能力がありますが、ウイルスを100%不活化することはできません。ウイルスを不活化する方法に関しては、WHO/CDCが推奨する方法を参照するか、地域の規制に従って処理することができます。
パフォーマンス特性
感度そして特異性
SARS-CoV-2 抗原迅速検査カセットは、患者から採取された検体で評価されています。PCR は、SARS-CoV-2 抗原迅速検査カセットの参照方法として使用されています。PCR で陽性の結果が示された場合、検体は陽性とみなされました。
| 方法 | RT-PCR | 合計結果 | ||
| SARS-CoV-2抗原迅速検査カセット | 結果 | ポジティブ | ネガティブ | |
| ポジティブ | 38 | 3 | 41 | |
| ネガティブ | 2 | 360 | 362 | |
| 合計結果 | 40 | 363 | 403 | |
相対感度:95.0%(95%CI*:83.1%-99.4%)
相対特異度:99.2%(95%CI*:97.6%-99.8%)
*信頼区間
検出限界
ウイルス含有量が400TCIDを超える場合50/mlでは、陽性検出率は95%以上です。ウイルス含有量が200TCID未満の場合、50/mlでは陽性検出率が95%未満であるため、この製品の最小検出限界は400TCIDです。50/ml。
精度
3バッチ連続の試薬の精度試験を実施しました。異なるバッチの試薬を用いて、同じ陰性サンプルを10回連続で検査したところ、すべて陰性でした。また、異なるバッチの試薬を用いて、同じ陽性サンプルを10回連続で検査したところ、すべて陽性でした。
フック効果
検査対象サンプル中のウイルス含有量が4.0*10に達すると5TCID50/ml、テスト結果にはまだ HOOK 効果は見られません。
交差反応性
キットの交差反応性を評価した結果、以下の検体との交差反応性は認められませんでした。
| 名前 | 集中 |
| HCOV-HKU1 | 105TCID50/ml |
| 黄色ブドウ球菌 | 106TCID50/ml |
| A群連鎖球菌 | 106TCID50/ml |
| 麻疹ウイルス | 105TCID50/ml |
| おたふく風邪ウイルス | 105TCID50/ml |
| アデノウイルス3型 | 105TCID50/ml |
| マイコプラズマ肺炎 | 106TCID50/ml |
| パラインフルエンザウイルス2型 | 105TCID50/ml |
| ヒトメタニューモウイルス | 105TCID50/ml |
| ヒトコロナウイルスOC43 | 105TCID50/ml |
| ヒトコロナウイルス229E | 105TCID50/ml |
| ボルデテラ・パラ百日咳菌 | 106TCID50/ml |
| インフルエンザB型ビクトリア株 | 105TCID50/ml |
| インフルエンザB型Y株 | 105TCID50/ml |
| インフルエンザA H1N1 2009 | 105TCID50/ml |
| インフルエンザA型H3N2 | 105TCID50/ml |
| H7N9 | 105TCID50/ml |
| H5N1 | 105TCID50/ml |
| エプスタイン・バーウイルス | 105TCID50/ml |
| エンテロウイルスCA16 | 105TCID50/ml |
| ライノウイルス | 105TCID50/ml |
| RSウイルス | 105TCID50/ml |
| 肺炎球菌 | 106TCID50/ml |
| カンジダ・アルビカンス | 106TCID50/ml |
| クラミジア肺炎 | 106TCID50/ml |
| 百日咳菌 | 106TCID50/ml |
| ニューモシスチス・イロベチ | 106TCID50/ml |
| 結核菌 | 106TCID50/ml |
| レジオネラ・ニューモフィラ | 106TCID50/ml |
I妨害物質
以下の濃度の物質では試験結果に影響はありません。
| 干渉する 物質 | 濃縮 | 妨害物質 | 濃縮 |
| 全血 | 4% | 複合ベンゾインゲル | 1.5mg/ml |
| イブプロフェン | 1mg/ml | クロモグリク酸 | 15% |
| テトラサイクリン | 3ug/ml | クロラムフェニコール | 3ug/ml |
| ムチン | 0.5% | ムピロシン | 10mg/ml |
| エリスロマイシン | 3ug/ml | オセルタミビル | 5mg/ml |
| トブラマイシン | 5% | ナファゾリン塩酸塩点鼻薬 | 15% |
| メントール | 15% | フルチカゾンプロピオン酸エステルスプレー | 15% |
| アフリン | 15% | 塩酸デオキシエピネフリン | 15% |
参考文献
1. Weiss SR、Leibowitz JZ.「コロナウイルスの病原性」Adv Virus Res 2011;81:85-164
2.Cui J、Li F、Shi ZL。病原性コロナウイルスの起源と進化。Nat Rev Microbiol 2019;17:181-192。
3.Su S、Wong G、Shi W、et al.コロナウイルスの疫学、遺伝子組換え、および病因.TrendsMicrobiol 2016;24:490-502.