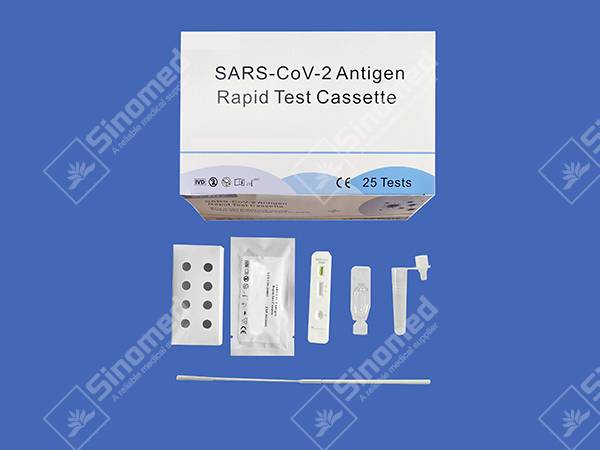
ตลับทดสอบอย่างรวดเร็วของ SARS-CoV-2 Antigen
คำอธิบายสั้น:
SARS-CoV-2 Antigen Rapid Test Cassette เป็นการตรวจทางโครมาโตกราฟีแบบรวดเร็วสำหรับการตรวจหาแอนติเจน SARS-CoV-2 ในเชิงคุณภาพในไม้กวาด Oropharyngeal ของมนุษย์ การระบุจะขึ้นอยู่กับโมโนโคลนอลแอนติบอดีจำเพาะสำหรับโปรตีนนิวคลีโอแคปซิด (N) ของโรคซาร์ส- CoV-2 มีจุดมุ่งหมายเพื่อช่วยในการวินิจฉัยแยกโรคอย่างรวดเร็วของการติดเชื้อ COVID-19
วัตถุประสงค์การใช้งาน
ที่ตลับทดสอบอย่างรวดเร็วของ SARS-CoV-2 Antigenเป็นการตรวจทางอิมมูโนแอสเซย์แบบโครมาโตกราฟีแบบรวดเร็วสำหรับการตรวจหาแอนติเจน SARS-CoV-2 ในเชิงคุณภาพในผ้าเช็ดปากของมนุษย์ การระบุจะขึ้นอยู่กับโมโนโคลนอลแอนติบอดีจำเพาะสำหรับโปรตีนนิวคลีโอแคปซิด (N) ของ SARS-CoV-2 โดยมีวัตถุประสงค์เพื่อช่วยใน การวินิจฉัยแยกโรคอย่างรวดเร็วของโควิด 19การติดเชื้อ.
ข้อมูลจำเพาะของแพ็คเกจ
25 การทดสอบ/แพ็ค, 50 การทดสอบ/แพ็ค, 100 การทดสอบ/แพ็ค
การแนะนำ
โคโรนาไวรัสสายพันธุ์ใหม่อยู่ในสกุล βโควิด 19เป็นโรคติดเชื้อทางเดินหายใจเฉียบพลัน โดยทั่วไปผู้คนมักอ่อนแอ ปัจจุบันผู้ป่วยที่ติดเชื้อไวรัสโคโรนาสายพันธุ์ใหม่เป็นสาเหตุหลักของการติดเชื้อ ส่วนผู้ติดเชื้อที่ไม่มีอาการก็สามารถเป็นแหล่งติดเชื้อได้เช่นกัน จากการตรวจสอบทางระบาดวิทยาในปัจจุบัน ระยะฟักตัวคือ 1 ถึง 14 วัน ส่วนใหญ่ 3 ถึง 7 วันอาการหลัก ได้แก่ มีไข้ เหนื่อยล้า และไอแห้งๆอาการคัดจมูก น้ำมูกไหล เจ็บคอ ปวดกล้ามเนื้อ และท้องเสีย พบได้ในบางกรณี
รีเอเจนต์
ตลับทดสอบประกอบด้วยอนุภาคโปรตีนนิวคลีโอแคปซิดที่ต้าน SARS-CoV-2 และโปรตีนนิวคลีโอแคปซิดที่ต้าน SARS-CoV-2 ที่เคลือบบนเมมเบรน
ข้อควรระวัง
โปรดอ่านข้อมูลทั้งหมดในส่วนแทรกของแพ็คเกจนี้ก่อนทำการทดสอบ
1.สำหรับมืออาชีพใช้การวินิจฉัยภายนอกร่างกายเท่านั้นห้ามใช้หลังจากวันหมดอายุ
2. การทดสอบควรอยู่ในซองที่ปิดสนิทจนกว่าจะพร้อมใช้งาน
3. ตัวอย่างทั้งหมดควรได้รับการพิจารณาว่ามีอันตรายและได้รับการจัดการในลักษณะเดียวกับสารติดเชื้อ
4. ควรทิ้งการทดสอบที่ใช้แล้วตามข้อบังคับท้องถิ่น
5.หลีกเลี่ยงการใช้ตัวอย่างเลือด
6. สวมถุงมือในการส่งตัวอย่าง หลีกเลี่ยงการสัมผัสเมมเบรนรีเอเจนต์และตัวอย่างอย่างดี
การจัดเก็บและการทรงตัว
ระยะเวลาที่ถูกต้องคือ 18 เดือนหากผลิตภัณฑ์นี้ถูกจัดเก็บในสภาพแวดล้อมของ
2-30 ℃ การทดสอบมีความเสถียรจนถึงวันหมดอายุที่พิมพ์บนซองที่ปิดสนิท การทดสอบจะต้องอยู่ในซองที่ปิดสนิทจนกว่าจะใช้งาน. อย่าแช่แข็งห้ามใช้เกินวันหมดอายุ
การเก็บตัวอย่างและการเตรียมตัวอย่าง
1.การเก็บสารคัดหลั่งในลำคอ: สอดผ้าฆ่าเชื้อเข้าไปในลำคอจากปาก โดยให้อยู่ตรงกลางผนังลำคอและบริเวณที่เป็นสีแดงของต่อมทอนซิลเพดานปาก เช็ดต่อมทอนซิลคอหอยทวิภาคีและผนังคอหอยด้านหลังด้วยระดับปานกลาง
แรง หลีกเลี่ยงการสัมผัสลิ้นและนำผ้าเช็ดออก
2. ดำเนินการตัวอย่างทันทีด้วยสารละลายสกัดตัวอย่างที่ให้มาในชุดหลังจากเก็บตัวอย่างแล้วหากไม่สามารถดำเนินการได้ในทันที ควรเก็บตัวอย่างไว้ในหลอดพลาสติกที่แห้ง ผ่านการฆ่าเชื้อ และปิดผนึกอย่างเคร่งครัดสามารถเก็บไว้ที่อุณหภูมิ 2-8°C ได้นาน 8 ชั่วโมง และสามารถเก็บไว้ได้นานที่ -70°C
3. ตัวอย่างที่มีการปนเปื้อนอย่างหนักจากเศษอาหารในช่องปากไม่สามารถใช้ในการทดสอบผลิตภัณฑ์นี้ได้ไม่แนะนำให้ใช้ตัวอย่างที่เก็บจากสำลีที่มีความหนืดหรือจับตัวเป็นก้อนเกินไปสำหรับการทดสอบผลิตภัณฑ์นี้หากสำลีปนเปื้อนเลือดจำนวนมาก ไม่แนะนำให้ทำการทดสอบไม่แนะนำให้ใช้ตัวอย่างที่ได้รับการประมวลผลด้วยสารละลายสกัดตัวอย่างที่ไม่ได้ให้มาในชุดอุปกรณ์นี้ในการทดสอบผลิตภัณฑ์นี้
ส่วนประกอบชุดอุปกรณ์
วัสดุให้
| ตลับทดสอบ | รีเอเจนต์การสกัด | หลอดสกัด | |
| ไม้กวาดฆ่าเชื้อ | การแทรกแพ็คเกจ | สถานีงาน |
วัตถุดิบที่จำเป็นแต่ไม่มีให้
| ตัวจับเวลา | สำหรับการใช้งานจับเวลา |
| บรรจุุภัณฑ์ |
ข้อมูลจำเพาะ25
การทดสอบ/แพ็ค50
การทดสอบ/แพ็ค100
การทดสอบ/แพ็ครีเอเจนต์การสกัดตัวอย่าง25 การทดสอบ/แพ็ค50 การทดสอบ/แพ็ค100 การทดสอบ/แพ็คการสกัดตัวอย่าง
หลอด≥25การทดสอบ/แพ็ค≥50การทดสอบ/แพ็ค≥100การทดสอบ/แพ็คคำแนะนำอ้างอิงถึง
แพคเกจอ้างถึง
แพคเกจอ้างถึง
บรรจุุภัณฑ์
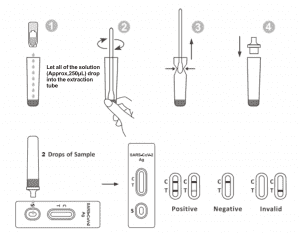
คำแนะนำสำหรับการใช้งาน
ปล่อยให้การทดสอบ ชิ้นงานทดสอบ และบัฟเฟอร์การสกัดปรับสมดุลกับอุณหภูมิห้อง (15-30°C) ก่อนการทดสอบ
1. นำตลับทดสอบออกจากซองฟอยล์ที่ปิดสนิทแล้วใช้งานภายใน 15 นาทีจะได้ผลลัพธ์ที่ดีที่สุดหากทำการทดสอบทันทีหลังจากเปิดถุงฟอยล์
2.วางท่อสกัดลงในสถานีงาน ถือขวดรีเอเจนต์สำหรับสกัดกลับหัวในแนวตั้ง บีบขวดแล้วปล่อยให้สารละลายทั้งหมด (ประมาณ 250μL) หยดลงในท่อสกัดอย่างอิสระโดยไม่ต้องสัมผัสขอบของท่อถึงจุดสกัด หลอด.
3. วางตัวอย่างไม้กวาดในหลอดสกัด หมุนไม้กวาดเป็นเวลาประมาณ 10 วินาทีในขณะที่กดหัวกับด้านในของหลอดเพื่อปล่อยแอนติเจนในไม้กวาด
4. ถอดสำลีออกในขณะที่บีบหัวสำลีเข้ากับด้านในของท่อสกัดในขณะที่คุณถอดออกเพื่อขับของเหลวออกจากก้านสำลีให้มากที่สุดเท่าที่จะเป็นไปได้ ทิ้งสำลีตามระเบียบปฏิบัติในการกำจัดของเสียจากอันตรายทางชีวภาพ
5. ติดตั้งปลายหยดที่ด้านบนของท่อสกัด วางตลับทดสอบไว้บนพื้นผิวที่สะอาดและได้ระดับ
6. เติมสารละลาย 2 หยด (ประมาณ 65μL) ลงในบ่อตัวอย่าง จากนั้นเริ่มจับเวลา อ่านผลลัพธ์ที่แสดงภายใน 20-30 นาที และผลลัพธ์ที่อ่านหลังจาก 30 นาทีไม่ถูกต้อง
การตีความผลลัพธ์
| เชิงลบ ผลลัพธ์: |
เส้นสีหนึ่งเส้นปรากฏขึ้นในบริเวณเส้นควบคุม (C)ไม่มีเส้นปรากฏในพื้นที่ทดสอบ (T) ผลลบบ่งชี้ว่าไม่มีแอนติเจน SARS-CoV-2 ในตัวอย่าง หรือต่ำกว่าระดับที่ตรวจพบได้ของการทดสอบ
เชิงบวกผลลัพธ์:
ปรากฏสองบรรทัด เส้นสีหนึ่งเส้นควรอยู่ในขอบเขตการควบคุม (C) และอีกเส้นสีที่ชัดเจนควรอยู่ในขอบเขตการทดสอบ (T) ผลบวกบ่งชี้ว่าตรวจพบ SARS-CoV-2 ในตัวอย่าง
ผลลัพธ์ไม่ถูกต้อง:
เส้นควบคุมไม่ปรากฏขึ้น ปริมาณตัวอย่างไม่เพียงพอหรือเทคนิคขั้นตอนที่ไม่ถูกต้องมักเป็นสาเหตุที่ทำให้สายควบคุมล้มเหลวทบทวนขั้นตอนและทำการทดสอบซ้ำด้วยการทดสอบใหม่หากปัญหายังคงอยู่ ให้หยุดใช้ชุดทดสอบทันทีและติดต่อตัวแทนจำหน่ายในพื้นที่ของคุณ
บันทึก:
ความเข้มของสีในพื้นที่ทดสอบ (T) จะแตกต่างกันไปขึ้นอยู่กับความเข้มข้นของแอนติเจน SARS-CoV-2 ที่มีอยู่ในชิ้นงานทดสอบดังนั้นเฉดสีใด ๆ ในบริเวณเส้นทดสอบ (T) ควรได้รับการพิจารณาว่าเป็นค่าบวก
ควบคุมคุณภาพ
- มีการควบคุมขั้นตอนในการทดสอบด้วยเส้นสีที่ปรากฏในพื้นที่ควบคุม (C) ถือเป็นการควบคุมขั้นตอนภายใน ซึ่งยืนยันว่าการดูดซับเมมเบรนเพียงพอ
- มาตรฐานการควบคุมไม่ได้มาพร้อมกับชุดอุปกรณ์นี้อย่างไรก็ตาม ขอแนะนำให้ทดสอบการควบคุมเชิงบวกและเชิงลบเพื่อเป็นแนวทางปฏิบัติในห้องปฏิบัติการที่ดีเพื่อยืนยันขั้นตอนการทดสอบและเพื่อตรวจสอบประสิทธิภาพการทดสอบที่เหมาะสม
ข้อจำกัดของการทดสอบ
- ที่ตลับทดสอบอย่างรวดเร็วของ SARS-CoV-2 Antigenมีไว้สำหรับใช้ในการวินิจฉัยภายนอกร่างกายโดยมืออาชีพเท่านั้น ควรใช้การทดสอบเพื่อตรวจหาแอนติเจน SARS-CoV-2 ในไม้กวาดช่องปาก ไม่สามารถกำหนดค่าเชิงปริมาณหรืออัตราการเพิ่มขึ้นของความเข้มข้นของ SARS-CoV-2 ได้ในเชิงคุณภาพนี้ ทดสอบ.
- ความแม่นยำของการทดสอบขึ้นอยู่กับคุณภาพของตัวอย่างไม้กวาด ผลลบลวงอาจส่งผลให้มีการจัดเก็บตัวอย่างที่ไม่เหมาะสม
- กล่องทดสอบอย่างรวดเร็วของ SARS-CoV-2 Antigen จะบ่งชี้เฉพาะการมีอยู่ของ SARS-CoV-2 ในตัวอย่างจากสายพันธุ์ไวรัสโคโรนา SARS-CoV-2 ทั้งที่มีชีวิตและไม่สามารถมีชีวิตได้
- เช่นเดียวกับการทดสอบวินิจฉัยทั้งหมด ผลลัพธ์ทั้งหมดจะต้องตีความร่วมกับข้อมูลทางคลินิกอื่นๆ ที่แพทย์มีอยู่
- ผลลบที่ได้รับจากชุดอุปกรณ์นี้ควรได้รับการยืนยันโดย PCR ผลลบอาจเกิดขึ้นได้หากความเข้มข้นของ SARS-CoV-2 ที่อยู่ในสำลีไม่เพียงพอหรือต่ำกว่าระดับที่ตรวจพบได้ในการทดสอบ
- เลือดหรือเมือกส่วนเกินบนตัวอย่างไม้กวาดอาจรบกวนการทำงานและอาจให้ผลบวกลวง
- ผลลัพธ์เชิงบวกของ SARS-CoV-2 ไม่ได้ขัดขวางการติดเชื้อร่วมกับเชื้อโรคอื่นดังนั้นควรคำนึงถึงความเป็นไปได้ของการติดเชื้อแบคทีเรียโดยไม่รู้ตัว
- ผลลัพธ์เชิงลบไม่ได้ตัดทอนการติดเชื้อ SARS-CoV-2 โดยเฉพาะในผู้ที่สัมผัสกับไวรัสการตรวจติดตามผลด้วยการวินิจฉัยระดับโมเลกุลควรได้รับการพิจารณาเพื่อป้องกันการติดเชื้อในบุคคลเหล่านี้
- ผลลัพธ์ที่เป็นบวกอาจเกิดจากการติดเชื้อโคโรนาไวรัสสายพันธุ์ที่ไม่ใช่ SARS-CoV-2 เช่น โคโรนาไวรัส HKU1, NL63, OC43 หรือ 229E
- ไม่ควรใช้ผลลัพธ์จากการทดสอบแอนติเจนเป็นพื้นฐานเพียงอย่างเดียวในการวินิจฉัยหรือยกเว้นการติดเชื้อ SARS-CoV-2 หรือเพื่อแจ้งสถานะการติดเชื้อ
- น้ำยาสกัดมีความสามารถในการฆ่าเชื้อไวรัส แต่ไม่สามารถยับยั้งไวรัสได้ 100% วิธีการยับยั้งไวรัสอาจอ้างอิงถึง: วิธีใดที่ WHO/CDC แนะนำ หรือสามารถจัดการได้ตามข้อบังคับท้องถิ่น
ลักษณะการทำงาน
ความไวและความจำเพาะ
ตลับทดสอบแบบรวดเร็ว Antigen ของ SARS-CoV-2 ได้รับการประเมินด้วยตัวอย่างที่ได้รับจากผู้ป่วย PCR ถูกใช้เป็นวิธีอ้างอิงสำหรับตลับทดสอบแบบรวดเร็ว Antigen ของ SARS-CoV-2 Antigen ตัวอย่างจะถือว่าเป็นบวกหาก PCR บ่งชี้ผลลัพธ์ที่เป็นบวก
| วิธี | RT-PCR | ผลลัพธ์ทั้งหมด | ||
| ตลับทดสอบอย่างรวดเร็วของ SARS-CoV-2 Antigen | ผลลัพธ์ | เชิงบวก | เชิงลบ | |
| เชิงบวก | 38 | 3 | 41 | |
| เชิงลบ | 2 | 360 | 362 | |
| ผลลัพธ์ทั้งหมด | 40 | 363 | 403 | |
ความไวสัมพัทธ์ :95.0%(95%CI*:83.1%-99.4%)
ความจำเพาะสัมพัทธ์:99.2%(95%CI*:97.6%-99.8%)
*ช่วงความเชื่อมั่น
ขีดจำกัดการตรวจจับ
เมื่อปริมาณไวรัสมากกว่า 400TCID50/ml อัตราการตรวจจับเชิงบวกมากกว่า 95%เมื่อปริมาณไวรัสน้อยกว่า 200TCID50/ml อัตราการตรวจจับเชิงบวกน้อยกว่า 95% ดังนั้นขีดจำกัดการตรวจจับขั้นต่ำของผลิตภัณฑ์นี้คือ 400TCID50/มล.
ความแม่นยำ
รีเอเจนต์สามชุดติดต่อกันได้รับการทดสอบเพื่อความแม่นยำมีการใช้รีเอเจนต์ที่แตกต่างกันเพื่อทดสอบตัวอย่างที่เป็นลบเดียวกัน 10 ครั้งติดต่อกัน และผลลัพธ์เป็นลบทั้งหมดรีเอเจนต์ชุดต่างๆ ถูกนำมาใช้ในการทดสอบตัวอย่างที่เป็นบวกเหมือนกัน 10 ครั้งติดต่อกัน และผลลัพธ์ทั้งหมดก็เป็นบวก
เอฟเฟกต์ตะขอ
เมื่อปริมาณไวรัสในตัวอย่างที่ทดสอบถึง 4.0*105TCID50/ml ผลการทดสอบยังคงไม่แสดงผล HOOK
ปฏิกิริยาข้าม
ปฏิกิริยาข้ามของชุดคิทได้รับการประเมินผลลัพธ์ไม่พบปฏิกิริยาข้ามกับตัวอย่างต่อไปนี้
| ชื่อ | ความเข้มข้น |
| HCOV-HKU1 | 105TCID50/มล |
| สแตฟิโลคอคคัส ออเรียส | 106TCID50/มล |
| สเตรปโตคอคกี้ กลุ่มเอ | 106TCID50/มล |
| ไวรัสหัด | 105TCID50/มล |
| ไวรัสคางทูม | 105TCID50/มล |
| อะดีโนไวรัสประเภท 3 | 105TCID50/มล |
| โรคปอดบวมจากไมโคพลาสมา | 106TCID50/มล |
| พาราอิมฟลูเอนซาไวรัส ชนิดที่ 2 | 105TCID50/มล |
| เมตานิวโมไวรัสของมนุษย์ | 105TCID50/มล |
| โคโรนาไวรัสของมนุษย์ OC43 | 105TCID50/มล |
| ไวรัสโคโรน่าของมนุษย์ 229E | 105TCID50/มล |
| โรคพาราเพอร์ทูซิสจากบอร์เดเทลลา | 106TCID50/มล |
| ไข้หวัดใหญ่สายพันธุ์ B วิกตอเรีย | 105TCID50/มล |
| ไข้หวัดใหญ่บี YSTRAIN | 105TCID50/มล |
| ไข้หวัดใหญ่สายพันธุ์ A H1N1 2009 | 105TCID50/มล |
| ไข้หวัดใหญ่ A H3N2 | 105TCID50/มล |
| H7N9 | 105TCID50/มล |
| เชื้อ H5N1 | 105TCID50/มล |
| ไวรัสเอพสเตน-บาร์ | 105TCID50/มล |
| เอนเทอโรไวรัส CA16 | 105TCID50/มล |
| ไรโนไวรัส | 105TCID50/มล |
| ไวรัส RSV | 105TCID50/มล |
| สเตรปโตคอคคัส นิวโมโมนีเออี | 106TCID50/มล |
| แคนดิดา อัลบิแคนส์ | 106TCID50/มล |
| โรคปอดบวมจากหนองในเทียม | 106TCID50/มล |
| ไอกรนบอร์เดเทลลา | 106TCID50/มล |
| โรคปอดบวม จิโรเวซี | 106TCID50/มล |
| เชื้อวัณโรค | 106TCID50/มล |
| โรคปอดบวมลีจิโอเนลลา | 106TCID50/มล |
Iสารรบกวน
ผลการทดสอบไม่ถูกรบกวนกับสารที่ความเข้มข้นต่อไปนี้:
| รบกวน สาร | คอน | สารรบกวน | คอน |
| เลือดทั้งหมด | 4% | เจลกำยานผสม | 1.5มก./มล |
| ไอบูโพรเฟน | 1มก./มล | โครโมลินไกลเคต | 15% |
| เตตราไซคลิน | 3 มก./มล | คลอแรมเฟนิคอล | 3 มก./มล |
| มูซิน | 0.5% | มูพิโรซิน | 10มก./มล |
| อิริโทรมัยซิน | 3 มก./มล | โอเซลทามิเวียร์ | 5มก./มล |
| โทบรามัยซิน | 5% | ยาหยอดจมูก Naphazoline Hydrochlo-ride | 15% |
| เมนทอล | 15% | สเปรย์ฟลูติคาโซนโพรพิโอเนต | 15% |
| อาฟริน | 15% | ดีออกซีพิเนฟริน ไฮโดรคลอไรด์ | 15% |
บรรณานุกรม
1.Weiss SR, Leibowitz JZ. การเกิดโรคโคโรนาไวรัสAdv ไวรัส Res 2011;81:85-164
2.Cui J,Li F,Shi ZL.ต้นกำเนิดและวิวัฒนาการของโคโรนาไวรัสที่ทำให้เกิดโรคNat Rev Microbiol 2019;17:181-192.
3.Su S, Wong G, Shi W, และคณะ ระบาดวิทยา การรวมตัวกันทางพันธุกรรม และการเกิดโรคของโคโรนาไวรัสเทรนด์ไมโครไบโอล 2016;24:490-502.